EN ESTA SECCIÓN LES PRESENTARÉ ALGUNAS DE LAS COSAS QUE VI EN MIS CURSOS DE QUÍMICA
CONFIGURACIÓN ELECTRÓNICA
En química, la configuración electrónica indica la manera en la cual los electrones se estructuran, comunican u organizan en un átomo de acuerdo con el modelo de capas electrónicas, en el cual las funciones de ondas del sistema se expresan como un producto de orbitales antisimetrizado.12 La configuración electrónica es importante, ya que determina las propiedades de combinación química de los átomos y por lo tanto su posición en la tabla periódica de los elementos.

Radio Atómico
Identifica la distancia que existe entre el núcleo, y el orbital más externa de un átomo. Por medio del radio atómico, es posible determinar el tamaño del átomo.
Definiciones
ampliamente usadas de radio atómico incluyen:
·
Radio de Van der
Waals: en principio, la mitad de la distancia mínima entre los
núcleos de dos átomos del elemento que no están vinculados a la misma molécula.
·
Radio iónico: el radio nominal de los iones de
un elemento en un estado de ionización específica, deducida a partir de la
separación de los núcleos atómicos en sales cristalinas que incluyen el ion. En
principio, la separación entre dos iones de carga opuesta adyacentes debe ser
igual a la suma de sus radios iónicos.
·
Radio covalente: el radio nominal de los
átomos de un elemento cuando tienen enlace covalente con otros átomos, como
se deduce de la separación entre los núcleos atómicos en las moléculas. En
principio, la distancia entre dos átomos que están unidos el uno al otro en una
molécula (la longitud de ese enlace covalente) debe ser igual a la suma de sus
radios covalentes.
·
Radio metálico:
el radio nominal de átomos de un elemento cuando se unen a otros átomos
por enlace metálico.[cita requerida]
·
Radio de Bohr: el radio de la órbita del
electrón de menor energía predicho por el modelo de Bohr del átomo (1913. Es
aplicable únicamente a los átomos e iones con un solo electrón, como el hidrógeno, helio simplemente
ionizado, y positronio. Aunque el
modelo en sí ya está obsoleto, el radio de Bohr para el átomo de hidrógeno se
considera una constante física importante.
Propiedades
·
En un mismo grupo,
el radio atómico aumenta de arriba abajo con la cantidad de niveles de energía.
Al ser mayor el nivel de energía, el radio atómico es mayor.
·
En el mismo períodos,
el radio atómico aumenta de derecha a izquierda, ya que al ir hacia la derecha,
el número atómico (Z) aumenta en una unidad al pasar de un elemento a otro, es
decir, hay un aumento de carga nuclear por lo que los electrones son atraídos
más fuertemente hacia el núcleo disminuyendo así el radio atómico.
·
El radio atómico puede ser covalente o metálico. La
distancia entre núcleos de átomos "vecinos" en una molécula es la
suma de sus radios covalentes, mientras que el radio metálico es la mitad de la
distancia entre núcleos de átomos "vecinos" en cristales metálicos.
Usualmente, por radio atómico se ha de entender radio covalente.
Electrones de Valencia
Los electrones
de valencia son los electrones Formados
en lineas con puntos que se encuentran en la capa de mayor nivel de energía
del átomo,
siendo estos los responsables de la interacción entre
átomos de distintos elementos o entre los átomos del mismo elemento, también
siendo utilizados en la formación de compuestos debido a que presentan
facilidad para formar enlaces.
Estos enlaces pueden darse de diferente manera, ya sea la
transformación de estos elementos, por compartición de pares entre los átomos
en cuestión o por el tipo de interacción que se presenta en el enlace gaseoso, que
consiste en un "traslape" de bandas. Según sea el número de estos
electrones, será la cantidad de enlaces que puede formar cada átomo con otro u
otros.
Sólo los electrones internos de un átomo se separan por otro
átomo lejano Por lo general, los electrones del interior son sustituidos en
menor medida y tampoco los electrones en las subcapas d llenas
y en las f, porque están en el interior del átomo y no en la
superficie.
La valencia de un
elemento es el número de electrones que necesita o que le sobra para tener
completo su último nivel. La valencia de los gases nobles,
por tanto, será cero, ya que tienen completo el último nivel. En el caso
del sodio,
la valencia es 1, ya que tiene un solo electrón de valencia, si pierde un
electrón se queda con el último nivel completo.
Estructura de Lewis
La estructura de Lewis,también llamada diagrama
de punto y raya diagonal, modelo de Lewis, representación
de Lewis,fórmula de Lewis o regla de Octeto es una representación gráfica que muestra
los pares de electrones en guiones o puntos
de enlaces entre los átomos de
una molécula y
los pares de electrones solitarios que puedan
existir.2
Son representaciones bidimensionales sencillas de la conectividad de los átomos
en las moléculas; así como de la posición de los electrones enlazantes y no
enlazantes. En esta fórmula se muestran enlaces químicos dentro de la molécula,
ya sea explícitamente o implícitamente indicando la ordenación de los átomos en
el espacio.
Esta
representación se usa para saber la cantidad de electrones de valencia de un
elemento que interactúan con otros o entre su misma especie, formando enlaces
ya sea simples, dobles, o triples los cuales se encuentran íntimamente
relacionados con la geometría molecular.
En
las estructuras de Lewis se arreglan los átomos de manera que tengan una
configuración de gas noble (ocho electrones para los elementos del segundo
período de la tabla periódica específicamente para los pertenecientes a los
grupos principales y un par de electrones para el hidrógeno) . Muestran los
diferentes átomos usando su símbolo químico y líneas que se trazan entre los
átomos que se unen entre sí. En ocasiones, para representar cada enlace, se usan
pares de puntos en vez de líneas. Los electrones no enlazantes o par solitario
de electrones (los que no participan en los enlaces) se representan mediante
una línea o con un par de puntos, y deben colocarse siempre alrededor de los
átomos a los que pertenece.
Este
modelo fue propuesto por Gilbert Newton Lewis quién lo introdujo
por primera vez en 1916 en su artículo La molécula y el átomo.
Regla del Octeto
La regla del octeto,
establece que los átomos se enlazan unos a otros en el intento de completar su
capa de valencia (última capa de la configuración electrónica). La denominación
“regla del octeto” surgió en razón de la cantidad establecida de electrones
para la estabilidad de un elemento, es decir, el átomo queda estable cuando
presenta en su capa de valencia 8 electrones (Configuración de gas noble). Para
alcanzar tal estabilidad sugerida por la regla del octeto, cada elemento
precisa ganar, perder o compartir electrones en los enlaces químicos, de esa
forma ellos adquieren ocho electrones en la capa de valencia. por ejemplo los
átomos de oxígeno se enlazan para alcanzar la estabilidad sugerida por la regla
del octeto, presentando enlaces simples y dobles.
Considerando que cada enlace covalente simple aporta dos
electrones a cada átomo de la unión, al dibujar un diagrama o estructura de
Lewis, hay que evitar asignar más de ocho electrones a cada átomo.
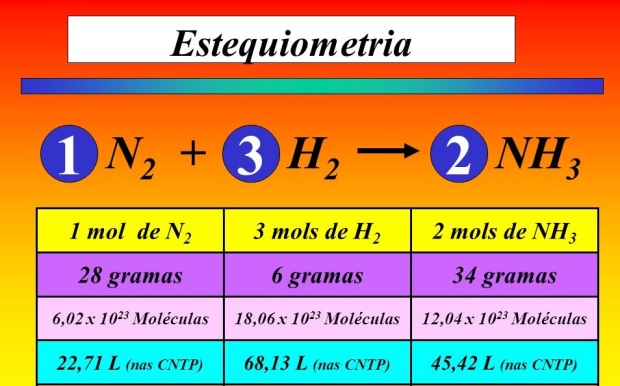
Estequiometría
En química, la estequiometría es el cálculo de las relaciones cuantitativas entre los reactivos y productos en el transcurso de una reacción química.1 Estas relaciones se pueden deducir a partir de la teoría atómica, aunque históricamente se enunciaron sin hacer referencia a la composición de la materia, según distintas leyes y principios.
El primero que enunció los principios de la estequiometría fue Jeremias Benjamin Richter (1762-1807), en 1792, quien describió la estequiometría de la siguiente manera:
«La estequiometría es la ciencia que mide las proporciones cuantitativas o relaciones de masa de los elementos químicos que están implicados (en una reacción química)».
También estudia la proporción de los distintos elementos en un compuesto químico y la composición de mezclas químicas.

No hay comentarios.:
Publicar un comentario